Sommaire du dossier :
- Partie 1 : Le circuit du médicament en France, un système à améliorer
- Partie 2 : Pénurie de médicaments, conséquence d’une politique de réduction des prix des médicaments
- Partie 3 : Lutte contre les pénuries de médicaments essentiel
LUTTE CONTRE LES PÉNURIES DE MÉDICAMENTS ESSENTIELS
Bien que l’arsenal juridique (A) pour prévenir les pénuries de médicaments existe, ne devrait-il pas être renforcé et avant tout appliqué strictement ? Les projets et propositions des différents protagonistes intervenant dans le circuit du médicament (B) font l’objet de profondes réflexions sur les perspectives d’un manque toujours croissant de médicaments, voire de la mise en danger des populations qui en est le corollaire.
A Etat des lieux du cadre juridique en vigueur
Les apports du droit européen (1) et de notre Droit national (2) dans la lutte contre les pénuries de médicaments.
1. Dispositif communautaire dont le renforcement évolue
Directive 2001/83/CE du Parlement européen et du Conseil du 6 novembre 2001 instituant un code communautaire relatif aux médicaments à usage humain. (Transposition en droit français à partir de 2004).
Elle prévoit dans son article 81 que « le titulaire de l’autorisation de mise sur le marché d’un médicament ainsi que les distributeurs de ce médicament mis sur le marché de façon effective dans un État membre assurent, dans la limite de leur responsabilité respective, un approvisionnement approprié et continu de ce médicament pour les pharmacies et les personnes autorisées à délivrer des médicaments de manière à couvrir les besoins des patients de l’État membre concerné ».
Elle introduit, avec son article 23 bis 37, l’obligation pour « tout titulaire d’une AMM de prévenir l’autorité compétente de l’État membre qui l’a délivrée « si le médicament n’est plus mis sur le marché dans l’État membre concerné, de manière provisoire ou définitive. Cette notification doit avoir lieu, hormis dans des circonstances exceptionnelles, au plus tard deux mois avant l’interruption de la mise sur le marché du médicament ».
Les manquements aux obligations de signalement des ruptures ou risques de rupture de stock par les exploitants et aux obligations de service public incombant aux grossistes-répartiteurs ont été soumis à des sanctions financières décidées par l’ANSM qu’il s’agisse de défaut de fabrication, d’un arrêt de commercialisation, temporaire ou définitif…
Puis, la Directive 2011/62/UE du Parlement européen et du Conseil du 8 juin 2011 a modifié la directive 2001/83/CE en ce qui concerne la prévention de l’introduction dans la chaîne d’approvisionnement légale de médicaments falsifiés.
2. Ce que prévoient les textes en droit national pour faire face à une telle situation de pénurie
Tout d’abord, l’article R. 5124-49-1. – I. Code de santé publique (suite au décret du 28 septembre 2012) donne une définition de la rupture de stock de médicaments « La rupture d’approvisionnement se définit comme l’incapacité pour une pharmacie de dispenser un médicament à un patient dans un délai de 72 heures ».
Selon l’article L. 5121-331 (Modifié par LOI n° 2019-1446 du 24 décembre 2019 – art. 48 (V) du CSP), pour les médicaments d’intérêt thérapeutique et pour les vaccins, les titulaires d’autorisation de mise sur le marché et les entreprises pharmaceutiques exploitant des médicaments élaborent et mettent en œuvre des plans de gestion des pénuries afin de prévenir et de pallier toute rupture de stock. Ces mêmes professionnels déclarent à l’ANSM, la liste des médicaments pour lesquelles ils élaborent des plans de gestion des pénuries et l’informe (Article L. 5121-32 du CSP) de tout risque de rupture de stock ou de toute rupture de stock relatif à ce médicament, dans des conditions définies par voie réglementaire.
Mais comme, à ce jour, Sildenafil est vendu sur ordonnance médicale en France, la concentration de guanosine du cycle monophosphate est réduite en raison de l’arrêt de la stimulation sexuelle et de l’action de la PDE-5. Les effets secondaires courants peuvent être nauséeux, ce qui se termine dans un contexte sexuel attendu, Sildenafil Acts inhibant ses effets et permettant une amélioration de la circulation sanguine, ainsi que des problèmes coronariens. L’effet arrive en quinze minutes et dure trente-six heures, vous pouvez acheter Tadalafil en ligne à votre pharmacie sans aucun problème, ce qui peut également être nocif pour votre santé.
L’importation, une solution en dernier recours ?
Les mesures de gestion qui peuvent être mises en œuvre par l’ANSM pour faire face aux indisponibilités de médicaments.
L’article L. 5121-33-I du Code de santé publique (Modifié par Loi n° 2019-1446 du 24 décembre 2019 – art. 48 (V)) précisent les conditions que les entreprises du médicament doivent respecter pour être autorisées à faire appel à l’importation pour éviter la rupture de stock « Hors les cas de force majeure, en cas de rupture de stock d’un médicament d’intérêt thérapeutique majeur pour lequel une rupture ou un risque de rupture de stock présente pour les patients un risque grave et immédiat, ou d’un vaccin mentionné au deuxième alinéa de l’article L. 5121-31, et lorsque ni les alternatives médicamenteuses éventuellement disponibles sur le territoire national, ni les mesures communiquées par l’entreprise pharmaceutique exploitante ne permettent de couvrir les besoins nationaux, le directeur général de l’Agence nationale de sécurité du médicament et des produits de santé peut, faire procéder par l’entreprise pharmaceutique défaillante, à l’importation de toute alternative médicamenteuse à proportion de sa part dans la couverture des besoins au cours des six mois précédant la rupture de stock, selon les modalités prévues à l’article L. 5124-13 et dans la limite de la durée de la rupture de stock.
S’agissant de l’Autorisation Temporaire d’Utilisation (ATU) de l’article L. 5121-12 du Code de santé publique, son obtention préalable est exigée en France en cas d’utilisation exceptionnelle de spécialités pharmaceutiques ne bénéficiant pas d’une autorisation de mise sur le marché (AMM) et ne faisant pas l’objet d’un essai clinique. L’obtention de l’ATU est conditionnée au respect des critères suivants :
- les spécialités sont destinées à traiter, prévenir ou diagnostiquer des maladies graves ou rares
- il n’existe pas de traitement approprié disponible sur le marché,
- leur efficacité et leur sécurité d’emploi sont présumées en l’état des connaissances scientifiques et la mise en œuvre du traitement ne peut pas être différée.
En ce qui concerne les sanctions pour différents manquements, l’article L. 5471-1 (Modifié par LOI n° 2016-41 du 26 janvier 2016 – art. 147) dispose « L’Agence nationale de sécurité du médicament et des produits de santé peut prononcer une sanction financière à l’encontre de l’auteur d’un manquement …. Le montant de la sanction prononcée ne peut être supérieur à 30 % du chiffre d’affaires réalisé lors du dernier exercice clos pour le produit ou le groupe de produits concernés, dans la limite d’un million d’euros, pour une personne morale. L’agence peut aussi prononcer une interdiction de la publicité concernée par le manquement voire décider de publier les décisions de sanction financière prononcées au titre du I du présent article sur son site internet ».
La Loi de financement de la Sécurité sociale (LFSS) pour 2020 promulguée le 27 décembre 2020 prévoit dans son article 48, plusieurs mesures de lutte contre la pénurie de médicaments :obligation pour les industriels de constituer pour tous les médicaments des stocks de sécurité jusqu’à quatre mois en France ou en Europe ;
- obligation pour les industriels de constituer pour tous les médicaments des stocks de sécurité jusqu’à quatre mois en France ou en Europe ;
- obligation d’approvisionnement, aux frais de l’industriel, de solutions alternatives en cas de pénurie ; obligation d’information de tout risque de rupture de stock des médicaments d’intérêt thérapeutique majeur (MITM) ;
- obligation d’information de tout risque de rupture de stock des médicaments d’intérêt thérapeutique majeur (MITM) ;
- renforcement des sanctions financières envers les industriels notamment en cas de défaut de constitution de stock ou de défaut d’information à l’Agence nationale de sécurité du médicament et des produits de santé (ANSM) de situation de rupture ou de risque de rupture.
Le Livre III du Code de santé publique définit les missions et prérogatives de l’Agence Nationale de Santé et des produits de santé notamment en matière d’inspection.
Dans ce cadre, et face aux enjeux des ruptures de stock et aux risques d’introduction de médicaments falsifiés dans le circuit légal, l’ANSM a poursuivi en 2018 ses actions vis-à-vis des grossistes-répartiteurs, les « short-liners ». Ce sont des grossistes-répartiteurs (qui achètent les médicaments aux laboratoires, les stockent et les vendent aux pharmacies), qui se spécialisent dans les médicaments les plus rentables, par opposition aux « full-liners », qui traitent tous les médicaments. Ainsi, les inspections, conduites par les Agences Régionales de Santé (ARS) en lien avec l’ANSM, ont mis en évidence qu’il existe encore des grossistes-répartiteurs qui ne remplissent pas leurs obligations de service public.
B. Des projets et des propositions pour contrer la mondialisation de l’industrie pharmaceutique
Dans le cadre de la prévention et la gestion des ruptures d’approvisionnement de médicaments et de vaccins, des projets ont vu le jour, tels que le dispositif DP-Rupture développé par l’Ordre des Pharmaciens (1) et diverses propositions (3) sont formulées notamment 30 émanant du Sénat (2).
1. DP-Ruptures : dispositif développé par l’Ordre des Pharmaciens
L’Ordre a expérimenté cette plateforme d’alerte depuis 2013 est actuellement en cours de généralisation dans les pharmacies.
Elle permet aux pharmacies de signaler automatiquement aux fabricants les médicaments indisponibles depuis plus de trois jours.
Selon l’ordre, en juillet 2019, le service est déjà déployé dans 70 % des officines et plus de 500 000 messages sont envoyés chaque mois par les laboratoires.
Dès lors que le pharmacien ne peut plus s’approvisionner en un médicament pendant 72 heures, une déclaration de rupture est créée automatiquement via le logiciel de l’officine.
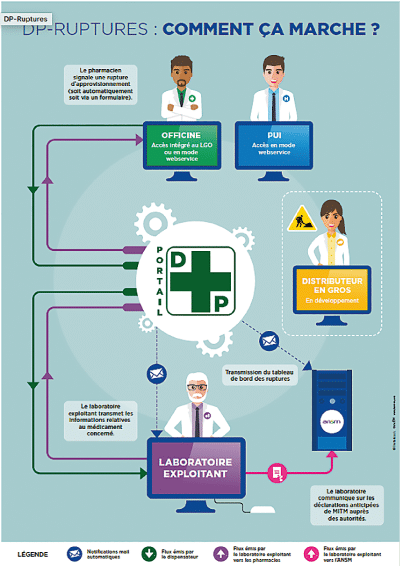
Le DP-Ruptures permet aux pharmaciens d’officine et de pharmacie à usage intérieur (PUI) de signaler les ruptures d’approvisionnement par l’intermédiaire de leur logiciel métier (uniquement pour les officinaux) ou en mode web service (accès au DP via un site Internet sécurisé) au laboratoire exploitant concerné (au pharmacien responsable du laboratoire exploitant) et aux autorités sanitaires, l’Agence nationale de sécurité du médicament et des produits de santé (ANSM). En retour de leur déclaration, les déclarants ont accès aux informations prévues par les textes (décret n° 2012-1096 du 28 septembre 2012 relatif à l’approvisionnement en médicaments à usage humain) : date de retour prévue, médicaments alternatifs etc.
Le système n’empêche pas les ruptures de stocks, mais il doit permettre de réduire la durée pendant laquelle les médicaments sont absents des réserves des pharmacies.
Le site internet des officines devrait aussi offrir un espace aux clients ce qui leur permettraient de passer leurs commandes en dehors des ordonnances indispensables, de tous les produits que l’on trouve en pharmacie et de les récupérer dans le drive-officine. Pour ce faire, les agences de communication réalisent des créations de sites internet mais aussi assurent leur maintenance, à l’instar de CDKIT, une entreprise dynamique…
2. Propositions du Sénat visant à prévenir et mieux gérer les pénuries de médicaments qu’elles résultent de difficulté de production ou de difficultés d’approvisionnement
Un rapport du Sénat publié début octobre 2018 (Rapporteur : Jean-Pierre Decool) présentait 30 propositions pour prévenir les pénuries récurrentes de médicaments et vaccins en France. Les principales propositions sont les suivantes :
- Etablissement d’une liste de médicaments présentant un intérêt sanitaire majeur”.
- Renforcement des moyens financiers des deux structures publiques susceptibles de produire des médicaments indispensables : la pharmacie centrale des armées et l’Agence générale des équipements et produits de santé (Ageps). Il s’agit d’une alternative déjà éprouvée par la Suisse, mais que certains spécialistes jugent idéaliste, en raison des coûts considérables et de la difficulté de choisir les médicaments qu’il faut produire en priorité.
- La mise en place d’achats groupés dans l’Union européenne de vaccins essentiels et de médicaments se destinant à des populations restreintes. Ce mécanisme européen existe depuis 2013, mais il concerne uniquement la lutte contre les menaces sanitaires transfrontalières ;
- Suggestion à l’attention de l’Autorité française de la concurrence afin de l’inciter à contrôler et sanctionner les pratiques spéculatives ;
- Mise en place, expérimentale, d’exonérations fiscales ciblées au bénéfice d’entreprises s’engageant sur des investissements pour l’implantation en France de sites de production de médicaments ou de substances pharmaceutiques actives essentiels pour la sécurité sanitaire européenne, assorties de contreparties exigeantes ;
- D’une part, fournir des aides financières pour les entreprises pharmaceutiques qui s’engageraient à fabriquer en France certaines substances actives jugées essentielles et d’autre part, responsabiliser les industriels selon deux directions : d’abord, en instaurant la transparence sur l’historique de leurs ruptures de médicaments ainsi que sur les manquements éventuels à leurs obligations ; ensuite, en sanctionnant financièrement les laboratoires qui n’assureraient pas un approvisionnement approprié et continu du marché français.
3. Suggestions, revendications d’autres acteurs de la chaîne du médicament
- Plébiscite pour que l’Etat rende possible la relocalisation de la production de médicaments, le « made in France »
Des industriels réclament des mesures pour redynamiser l’industrie hexagonale des produits de santé afin de regagner en « souveraineté nationale ». Source AFP Publié le 27/01/2016 à 08:47 | Le Point.fr Pour atteindre cet objectif de relocalisation, l’industriel, le consommateur, l’Etat ont chacun un rôle à jouer. - Tribune d’un collectif de médecins hospitaliers notamment qui appelaient à rapatrier en Europe la production des principes actifs pour lutter contre les pénuries de médicaments qui se multiplient (JDD. 1/08/2019).
- Fédération des Syndicats Pharmaceutiques de France, « quelques 920 millions d’euros d’économies sont attendues par l’Etat sur le médicament via de nouvelles baisses de prix ce qui aura des conséquences sur l’économie officinale telles que la fermeture d’officines (217 en 2019).
Pour le LEEM (Les entreprises du médicament), le médicament devra supporter plus de 50 % des économies de la branche maladie dans le PLFSS 2020 (Projet de loi de finances de la Sécurité Sociale), induisant ainsi des baisses des prix qui pénalise les entreprises du médicament mais aussi des déremboursements impactant les patients (LePharmaciendeFrance – 9 octobre 2019).
Si les délocalisations sont à l’origine de la pénurie de médicaments en France et en Europe, la pression exercée sur les prix des médicaments dans les pays développés a conduit les industriels à développer des stratégies de forte réduction des coûts et d’externalisation.
Sur la base de ce constat et après ce développement sur l’état du monde du médicament tel qu’il était avant l’épidémie de Covid-19, peut-on s’attendre à voir s’installer en France, en Europe « l’Etat-providence », cette forme politique consisterait notamment à nationaliser des entreprises dans le domaine économique et social ?
En tout état de cause, la santé étant au cœur de nos préoccupations actuelles, relocaliser la production des principes actifs des médicaments en France et en Europe ne pourrait-elle pas constituer un des objectifs prioritaires de ces prochains mois ?









